Kecepatan Reaksi : Pengertian Penjelasan Dan Contohnya – Saat kecepatan reaksi kimia tertentu diukur dalam percobaan, kita menemukan kalau kecepatan ini ternyata tergantung pada konsentrasi zat pereaksi, suhu dan kuantitas yang disebut energi aktivasi. Ahli kimia menjelaskan fenomena ini dengan memakai teori kolisi untuk kecepatan reaksi. Teori ini bertopang pada premis kalau sebuah reaksi hanya terjadi antara dua atau lebih molekul, jika pada tingkat molekulnya, terjadi sebuah tabrakan (kolisi) antara dua molekul yang bergerak cepat. Bila kedua molekul bertabrakan dengan cara yang tepat dan dengan energi kinetik yang pas, salah satu molekul akan membutuhkan energi untuk memicu proses pelepasan ikatan. Saat ini terjadi, ikatan baru dapat terbentuk, dan pada akhirnya molekul pereaksi berubah menjadi molekul hasil. Titik energi tertinggi saat pelepasan ikatan dan pembuatan ikatan disebut keadaan transisi dari proses molekul tersebut. Perbedaan antara energi keadaan transisi dan energi molekul pereaksi disebut energi aktivasi yang harus dilampaui agar reaksi dapat terjadi. Kecepatan reaksi meningkat seiring bertambahnya suhu karena molekul yang bertabrakan memiliki energi yang lebih besar, dan lebih banyak lagi molekul yang akan memiliki energi yang melebihi energi aktivasi reaksi.
Kecepatan reaksi adalah banyaknya mol/liter suatu zat yang dapat berubah menjadi zat lain dalam setiap satuan waktu.
Untuk reaksi: aA + bB => mM + nN
maka kecepatan reaksinya adalah:
1 (dA) 1 d(B) 1 d(M) 1 d(N)
V = – ——- = – ——- = + ——– = + ———-
a dt b dt m dt n dt
dimana:
– 1/a . d(A) /dt = rA = kecepatan reaksi zat A = pengurangan konsentrasi zat A per satuan wakru.
– 1/b . d(B) /dt = rB = kecepatan reaksi zat B = pengurangan konsentrasi zat B per satuan waktu.
– 1/m . d(M) /dt = rM = kecepatan reaksi zat M = penambahan konsentrasi zat M per satuan waktu.
– 1/n . d(N) /dt = rN = kecepatan reaksi zat N = penambahan konsentrasi zat N per satuan waktu.
Pada umumnya kecepatan reaksi akan besar bila konsentrasi pereaksi cukup besar. Dengan berkurangnya konsentrasi pereaksi sebagai akibat reaksi, maka akan berkurang pula kecepatannya.
Secara umum kecepatan reaksi dapat dirumuskan sebagai berikut:
V = k(A) x (B) y
dimana:
V = kecepatan reaksi
k = tetapan laju reaksi
x = orde reaksi terhadap zat A
y = orde reaksi terhadap zat B
(x + y) adalah orde reaksi keseluruhan
(A) dan (B) adalah konsentrasi zat pereaksi.
Orde Reaksi
Orde reaksi adalah banyaknya faktor konsentrasi zat reaktan yang mempengaruhi kecepatan reaksi.
Penentuan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaan.
Suatu reaksi yang diturunkan secara eksperimen dinyatakan dengan rumus kecepatan reaksi :
v = k (A) (B) 2
persamaan tersebut mengandung pengertian reaksi orde 1 terhadap zat A dan merupakan reaksi orde 2 terhadap zat B. Secara keselurahan reaksi tersebut adalah reaksi orde 3.
Contoh soal:
Dari reaksi 2NO(g) + Br2(g) => 2NOBr(g)
dibuat percobaan dan diperoleh data sebagai berikut:
No. (NO) mol/l (Br2) mol/l Kecepatan Reaksi
mol / 1 / detik
1. 0.1 0.1 12
2. 0.1 0.2 24
3. 0.1 0.3 36
4. 0.2 0.1 48
5. 0.3 0.1 108
Pertanyaan:
a. Tentukan orde reaksinya !
b. Tentukan harga k (tetapan laju reaksi) !
Jawab:
a. Pertama-tama kita misalkan rumus kecepatan reaksinya adalah V = k(NO)x(Br2)y : jadi kita harus mencari nilai x den y.
Untuk menentukan nilai x maka kita ambil data dimana konsentrasi terhadap Br2 tidak berubah, yaitu data (1) dan (4).
Dari data ini terlihat konsentrasi NO naik 2 kali sedangkan kecepatan reaksinya naik 4 kali maka :
2x = 4 => x = 2 (reaksi orde 2 terhadap NO)
Untuk menentukan nilai y maka kita ambil data dimana konsentrasi terhadap NO tidak berubah yaitu data (1) dan (2). Dari data ini terlihat konsentrasi Br2 naik 2 kali, sedangkan kecepatan reaksinya naik 2 kali, maka :
2y = 2 => y = 1 (reaksi orde 1 terhadap Br2)
Jadi rumus kecepatan reaksinya : V = k(NO)2(Br2) (reaksi orde 3)
b. Untuk menentukan nilai k cukup kita ambil salah satu data percobaan saja misalnya data (1), maka:
V = k(NO)2(Br2)
12 = k(0.1)2(0.1)
k = 12 x 103 mol-212det-1
Teori Tumbukan Dan Teori Keadaan Transisi
Teori tumbukan didasarkan atas teori kinetik gas yang mengamati tentang bagaimana suatu reaksi kimia dapat terjadi. Menurut teori tersebut kecepatan reaksi antara dua jenis molekul A dan B sama dengan jumiah tumbukan yang terjadi per satuan waktu antara kedua jenis molekul tersebut. Jumlah tumbukan yang terjadi persatuan waktu sebanding dengan konsentrasi A dan konsentrasi B. Jadi makin besar konsentrasi A dan konsentrasi B akan semakin besar pula jumlah tumbukan yang terjadi.
TEORI TUMBUKAN INI TERNYATA MEMILIKI BEBERAPA KELEMAHAN, ANTARA LAIN :
– tidak semua tumbukan menghasilkan reaksi sebab ada energi tertentu yang harus dilewati (disebut energi aktivasi = energi pengaktifan) untak dapat menghasilkan reaksi. Reaksi hanya akan terjadi bila energi tumbukannya lebih besar atau sama dengan energi pengaktifan (Ea).
– molekul yang lebih rumit struktur ruangnya menghasilkan tumbukan yang tidak sama jumlahnya dibandingkan dengan molekul yang sederhana struktur ruangnya.
Teori tumbukan di atas diperbaiki oleh teori keadaan transisi atau teori laju reaksi absolut. Dalam teori ini diandaikan bahwa ada suatu keadaan yang harus dilewati oleh molekul-molekul yang bereaksi dalam tujuannya menuju ke keadaan akhir (produk). Keadaan tersebut dinamakan keadaan transisi. Mekanisme reaksi keadaan transisi dapat ditulis sebagai berikut:
A + B => T* –> C + D
Dimana:
– A dan B adalah molekul-molekul pereaksi
– T* adalah molekul dalam keadaan transisi
– C dan D adalah molekul-molekul hasil reaksi
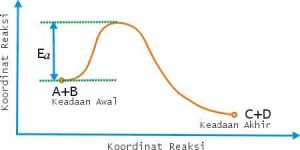 SECARA DIAGRAM KEADAAN TRANSISI INI DAPAT DINYATAKAN SESUAI KURVA BERIKUT :
SECARA DIAGRAM KEADAAN TRANSISI INI DAPAT DINYATAKAN SESUAI KURVA BERIKUT :
Dari diagram terlibat bahwa energi pengaktifan (Ea) merupakan energi keadaan awal sampai dengan energi keadaan transisi. Hal tersebut berarti bahwa molekul-molekul pereaksi harus memiliki energi paling sedikit sebesar energi pengaktifan (Ea) agar dapat mencapai keadaan transisi (T*) dan kemudian menjadi hasil reaksi (C + D).
Catatan :
Energi pengaktifan (= energi aktivasi) adalah jumlah energi minimum yang dibutuhkan oleh molekul-molekul pereaksi agar dapat melangsungkan reaksi.
Tahap Menuju Kecepatan Reaksi
Dalam suatu reaksi kimia berlangsungnya suatu reaksi dari keadaan semula (awal) sampai keadaan akhir diperkirakan melalui beberapa tahap reaksi.
Contoh: 4 HBr(g) + O2(g) => 2 H2O(g) + 2 Br2(g)
Dari persamaan reaksi di atas terlihat bahwa tiap 1 molekul O2 bereaksi dengan 4 molekul HBr. Suatu reaksi baru dapat berlangsung apabila ada tumbukan yang berhasil antara molekul-molekul yang bereaksi. Tumbukan sekaligus antara 4 molekul HBr dengan 1 molekul O2 kecil sekali kemungkinannya untuk berhasil. Tumbukan yang mungkin berhasil adalah tumbukan antara 2 molekul yaitu 1 molekul HBr dengan 1 molekul O2. Hal ini berarti reaksi di atas harus berlangsung dalam beberapa tahap dan diperkirakan tahap-tahapnya adalah :
Tahap 1: HBr + O2 => HOOBr (lambat)
Tahap 2: HBr + HOOBr => 2HOBr (cepat)
Tahap 3: (HBr + HOBr => H2O + Br2) x 2 (cepat)
—————————————————— +
4 HBr + O2 –> 2H2O + 2 Br2
Dari contoh di atas ternyata secara eksperimen kecepatan berlangsungnya reaksi tersebut ditentukan oleh kecepatan reaksi pembentukan HOOBr yaitu reaksi yang berlangsungnya paling lambat.
Rangkaian tahap-tahap reaksi dalam suatu reaksi disebut “mekanisme reaksi” dan kecepatan berlangsungnya reaksi keselurahan ditentukan oleh reaksi yang paling lambat dalam mekanisme reaksi. Oleh karena itu, tahap ini disebut tahap penentu kecepatan reaksi.
Faktor-Faktor Yang Mempengaruhi Kecepatan Reaksi
Beberapa faktor yang mempengaruhi kecepatan reaksi antara lain konsentrasi, sifat zat yang bereaksi, suhu dan katalisator.
A. KONSENTRASI
Dari berbagai percobaan menunjukkan bahwa makin besar konsentrasi zat-zat yang bereaksi makin cepat reaksinya berlangsung. Makin besar konsentrasi makin banyak zat-zat yang bereaksi sehingga makinbesar kemungkinan terjadinya tumbukan dengan demikian makin besar pula kemungkinan terjadinya reaksi.
B. SIFAT ZAT YANG BEREAKSI
Sifat mudah sukarnya suatu zat bereaksi akan menentukan kecepatan berlangsungnya reaksi.
Secara umum dinyatakan bahwa:
– Reaksi antara senyawa ion umumnya berlangsung cepat.
Hal ini disebabkan oleh adanya gaya tarik menarik antara ion-ion yang muatannya berlawanan.
Contoh: Ca2+(aq) + CO32+(aq) => CaCO3(s)
Reaksi ini berlangsung dengan cepat.
– Reaksi antara senyawa kovalen umumnya berlangsung lambat.
Hal ini disebabkan karena untuk berlangsungnya reaksi tersebut dibutuhkan energi untuk memutuskan ikatan-ikatan kovalen yang terdapat dalam molekul zat yang bereaksi.
Contoh: CH4(g) + Cl2(g) => CH3Cl(g) + HCl(g)
Reaksi ini berjalan lambat reaksinya dapat dipercepat apabila diberi energi misalnya cahaya matahari.
C. SUHU
Pada umumnya reaksi akan berlangsung lebih cepat bila suhu dinaikkan. Dengan menaikkan suhu maka energi kinetik molekul-molekul zat yang bereaksi akan bertambah sehingga akan lebih banyak molekul yang memiliki energi sama atau lebih besar dari Ea. Dengan demikian lebih banyak molekul yang dapat mencapai keadaan transisi atau dengan kata lain kecepatan reaksi menjadi lebih besar. Secara matematis hubungan antara nilai tetapan laju reaksi (k) terhadap suhu dinyatakan oleh formulasi ARRHENIUS:
k = A . e-E/RT
dimana:
k : tetapan laju reaksi
A : tetapan Arrhenius yang harganya khas untuk setiap reaksi
E : energi pengaktifan
R : tetapan gas universal = 0.0821.atm/moloK = 8.314 joule/moloK
T : suhu reaksi (oK)
D. KATALISATOR
Katalisator adalah zat yang ditambahkan ke dalam suatu reaksi dengan maksud memperbesar kecepatan reaksi. Katalis terkadang ikut terlibat dalam reaksi tetapi tidak mengalami perubahan kimiawi yang permanen, dengan kata lain pada akhir reaksi katalis akan dijumpai kembali dalam bentuk dan jumlah yang sama seperti sebelum reaksi.
Fungsi katalis adalah memperbesar kecepatan reaksinya (mempercepat reaksi) dengan jalan memperkecil energi pengaktifan suatu reaksi dan dibentuknya tahap-tahap reaksi yang baru. Dengan menurunnya energi pengaktifan maka pada suhu yang sama reaksi dapat berlangsung lebih cepat.
Studi modern berdasarkan molekul pada perubahan kimia telah sangat dibantu oleh keberadaan laser dan komputer. Sekarang kita bisa mempelajari hasil reaksi tumbukan yang berusia sangat pendek dan menentukan lebih baik mekanisme molekuler yang sesuai dengan kecepatan reaksi kimia. Pengetahuan ini berguna dalam merancang katalis jenis baru yang dapat mempercepat reaksi dengan menurunkan energi aktivasinya. Katalis penting untuk banyak proses industri dan biokimia karena ia mempercepat reaksi yang bila secara alami dibiarkan begitu saja, maka ia akan berlangsung sangat lama. Selain itu, ia melakukannya dengan meningkatkan pengendalian pada struktur molekul yang dihasilkan. Ambil contoh katalis rhodium phosphine, ia mampu membuat ahli kimia mendapatkan 96 persen isomer optik yang sesuai dalam langkah kunci sintesis L-dopa, sebuah obat yang diperlukan untuk penyembuhan penyakit Parkinson.

